A importação de medicamentos é um tema relevante para as empresas que atuam com a sua fabricação e a logística nos centros de distribuição.
Como se trata de produtos sob vigilância sanitária, os medicamentos e insumos farmacêuticos (IFAs) necessitam da anuência da Agência Nacional de Vigilância Sanitária (ANVISA), órgão regulador do setor no Brasil, para a operação de importação e/ou exportação.
Em 2020, com o crescimento da pandemia de Covid-19, a importação de medicamentos teve um crescimento exponencial. Até maio, ocupou a 7ª posição no ranking dos principais produtos importados.
Entenda, neste artigo, o passo a passo para importar medicamentos, a documentação necessária e como a tecnologia vem desburocratizando a operação.
Continue a leitura!
Medicamentos: Entenda como funciona o processo de importação
Os medicamentos são produtos que possuem alto consumo entre os cidadãos. Os Insumos Farmacêuticos Ativos (IFAs) também estão com alta demanda, já que são componentes primordiais para a fabricação das vacinas contra o novo coronavírus.
A cadeia de suprimentos da indústria farmacêutica vem passando por desafios, principalmente neste período, em que a população passou a buscar mais medicamentos antigripais, suplementos vitamínicos, entre outras medicações.
O aumento da população idosa também é refletido no crescimento do consumo de medicamentos, de uma forma geral.
De acordo com dados divulgados pela IQVIA, os idosos são responsáveis pela movimentação de mais de R$1 trilhão de reais, e, a partir dos 65 anos manifestam cerca de quatro doenças crônicas, chegando a tomar mais de cinco medicamentos por dia.
Por isso, o gestor da cadeia de suprimentos da indústria farmacêutica precisa acompanhar as tendências populacionais, a fim de manter o mercado abastecido e consequentemente, aquecido.
China, Índia, Tailândia, EUA e Suíça, estão entre os países que têm como foco a produção de medicamentos e insumos voltados à exportação.
Leia também: Licença de Importação (LI): Entenda a sua relevância para a importação de vacinas.
Agora que contextualizamos o cenário do consumidor, vamos entender como funciona o processo de importação de medicamentos?
Uma das atribuições da ANVISA é o controle das importações dos medicamentos, já que a sua missão é a proteção da saúde da população.
A Resolução da Diretoria Colegiada – RDC Nº 81 de 11 de novembro de 2008 dispõe sobre o Regulamento Técnico de Bens e Produtos Importados para fins de Vigilância Sanitária.
Em seu parágrafo 1º, a RDC aborda o conceito dos serviços de importação no setor:
“Consideram-se serviços de importação procedida por intermediação predeterminada àqueles prestados por pessoa jurídica que promova despacho aduaneiro de mera importação de bem e produto sujeito à vigilância sanitária, adquirida no exterior, em razão de contrato firmado com terceiro, empresa autorizada/licenciada junto ao Sistema Nacional de Vigilância Sanitária – SNVS, detentora da regularização do produto perante o órgão de vigilância sanitária pertinente”.
A importação de medicamentos deverá ocorrer por meio da inserção da Licença de Importação (LI) no Portal Siscomex.
Tecnologia otimiza o processo de importação de medicamentos
Para dar mais celeridade no processo de fiscalização e liberação (ou não), foram criados postos de vigilância sanitária únicos e separados por assuntos.
Além disso, todo o processo passou a ser eletrônico, com a utilização da anexação digital de documentos no Portal Único Siscomex.
Os postos são divididos da seguinte forma:
- Posto de Vigilância Sanitária de Portos, Aeroportos, Fronteiras e Recintos Alfandegados em Produtos para a Saúde (PAFPS);
- Posto de Vigilância Sanitária de Portos, Aeroportos, Fronteiras e Recintos Alfandegados em Medicamentos (PAFME);
- Posto de Vigilância Sanitária de Portos, Aeroportos, Fronteiras e Recintos Alfandegados em Alimentos (PAFAL);
- Posto de Vigilância Sanitária de Portos, Aeroportos, Fronteiras e Recintos Alfandegados em Cosméticos, Saneantes, Higiene e Outros (PAFCO).
Leia também: DUIMP: Conheça as novas alterações da Declaração de Importação
No caso dos medicamentos, o posto da Anvisa responsável pela análise dos processos de importação é o PAFME.
O processo de importação de medicamentos deverá ser realizado de forma eletrônica, por meio do Peticionamento Eletrônico de Importação (PEI).
A fim de facilitar o procedimento, a ANVISA criou uma cartilha explicativa sobre as etapas que devem ser seguidas pelo importador e/ou o seu representante legal.
No documento, constam orientações gerais para o envio da documentação eletrônica ao órgão.
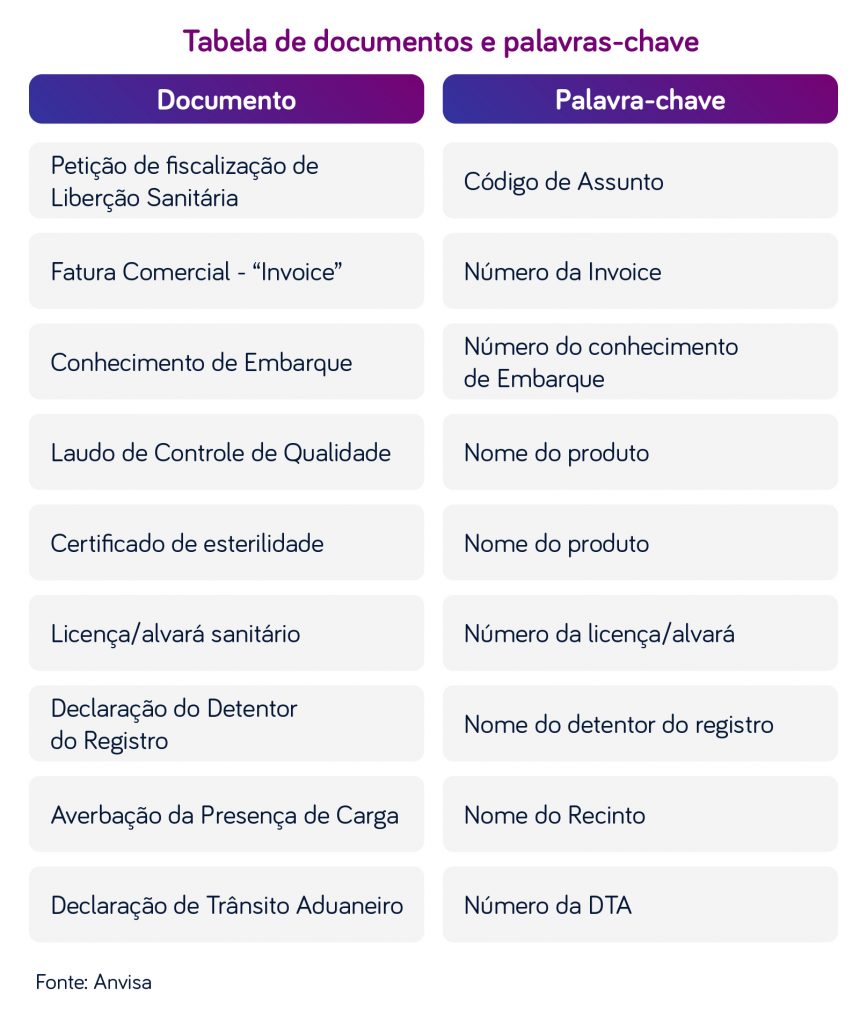
Os documentos deverão ser identificados, nos arquivos individuais, por meio de palavra-chave obrigatória, conforme a tabela a seguir:
Outro passo importante é a definição do código da Nomenclatura Comum do Mercosul (NCM) e classificação do produto – com o cuidado para não inserir dados errados e assim gerar multas.
Além disso, é necessário verificar se o material precisará ser analisado por algum órgão antes de ser nacionalizado ou antes de entrar no país, visto que cada um tem as suas peculiaridades e requerimentos específicos.
Alguns itens precisam de autorização prévia devido à sua composição e/ou quantidade.
Outro ponto importante, é referente ao tipo de modal que será utilizado no transporte do medicamento.
O importador deverá ter atenção ao controle de temperatura, embalagem correta e armazenagem, a fim de evitar qualquer tipo de contaminação que seja prejudicial à eficácia e segurança do medicamento ou insumo.
Leia também: Logística Farmacêutica: Como a previsibilidade otimiza a distribuição de insumos e medicamentos
Documentos necessários
Essa é uma dúvida comum. Confira abaixo quais documentos você deve ter para iniciar o processo de importação de medicamentos:
- Petição para Fiscalização e Liberação Sanitária de que trata o subitem 1.2. do Capítulo II da RDC nº 81/2008;
- Extrato da Licença de Importação (LI);
- Fatura Comercial (Invoice) – com a via original assinada;
- Conhecimento de carga embarcada – com a via original assinada;
- Laudo Analítico de Controle de Qualidade – por lote ou partida, emitido pelo fabricante – via original assinada ou cópia assinada e carimbada pelo Responsável Técnico do importador);
- Declaração do Detentor do Registro (DDR) – para as importações cujo importador não é o detentor da regularização do produto.
Essa documentação mencionada, deverá ser anexada no Portal Único Siscomex, por meio do módulo Anexação Eletrônica de Documentos.
Leia também: Programa OEA: Entenda a sua importância para o comércio exterior
Certificado de Autorização de Funcionamento (Certificado AFE)
Este documento é emitido pela ANVISA, comprovando que a empresa está autorizada a exercer as atividades descritas no certificado.
O certificado de AFE é voltado para a utilização em âmbito nacional e quando se tratar de atividade voltada à exportação.
Quando da utilização do documento em âmbito nacional, será necessário realizar o pagamento da Taxa de Fiscalização de Vigilância Sanitária (TFVS).
Já quando a utilização do Certificado de AFE é voltado à exportação, a taxa é isenta.
De acordo com a ANVISA, o valor da taxa varia de acordo com a quantidade de itens presentes na LI e o porte ou faturamento bruto anual das empresas classificadas conforme a seguir:

Lei 13.410/2016
A Lei 13.410/2016 institui o Sistema Nacional de Controle de Medicamentos (SNCM), cujo objetivo é o controle da produção, distribuição, comercialização, dispensação, prescrição médica e odontológica de medicamentos.
De acordo com a norma, o controle será feito por meio de sistema de identificação individualizado de medicamentos, com a utilização de tecnologias de captura, armazenamento e transmissão eletrônica de dados, contendo as seguintes informações:
- Nº de registro do medicamento no órgão de Vigilância Sanitária Federal competente;
- Nº de série único do medicamento;
- Nº do lote ou do part number;
- Data de validade.
Outro ponto importante é referente à rastreabilidade que tem como objetivo o acompanhamento dos medicamentos em todas as etapas da cadeia produtiva, desde a fabricação até o consumo.
O motivo é a promoção de mais segurança aos profissionais em relação aos medicamentos utilizados e aos pacientes, além de melhorar o controle da logística na indústria farmacêutica e nos centros de distribuição, a fim de realizar a manutenção dos padrões regulatórios de conformidade.
A realização de testes, validação e implementação da rastreabilidade no Brasil tem o prazo finalizado em 28 de abril de 2022.
Conclusão
Neste artigo, você conferiu o funcionamento do processo de importação de medicamentos no Brasil, a documentação necessária e os dados mais recentes sobre o setor.


